【參考】揭密國際藥物追溯體系現狀:看看歐美標桿范例細節
日期:2016/2/25
2016年1月,國務院辦公廳發布《關于加快推進重要產品追溯體系建設的意見》,對食品、藥品等追溯體系過程中存在的問題做出要求,并立下目標,力求到2020年完善追溯體系建設規劃標準體系,健全法規制度。由此看來,建立健全藥品跟蹤追溯體系將是“十三五”醫改的一大重要任務。目標一旦實現,中國藥品安全監管質量水準將得到大幅度提升。
為此,筆者對國際藥物跟蹤與追溯系統現狀,特別是體系成熟的美國和歐盟的現行成果進行了探討分析。
放眼國際,早在20世紀90年代,部分發達國家和地區已開始探索建立追溯制度來推進藥品質量安全管理。美國、歐盟多國是較早開展藥品追溯標準化工作的國家和地區,其已建立起來的法律法規體系和配套組織執行機構是目前全球范圍內最為健全完善的。這種以預防、控制和追溯為特征的藥品質量安全追溯監管體系,可使得藥品安全生產、流通、使用各環節受到全程監控。
除此之外,其他國家大都尚未形成較成熟的藥品追溯體系。即便是藥品安全監管在全球范圍內享有盛譽的日本和澳大利亞,目前也更多的是通過藥物監測系統中的藥品上市后安全信息收集、藥物警戒與召回等環節來實現安全追蹤。
其中,日本現行《藥品上市后安全監管質量管理規范》(Good Vigilance Practice,GVP)對藥品上市后的安全管理建立了一系列標準,涉及藥品合理使用信息的收集、準備和研究等,以及安全保障措施的實施。GVP中提及藥品安全管理信息的收集、基于安全管理信息監測的結果起草安全保障措施、安全保障措施的實施等內容。但日本現已有成熟的食品安全追溯系統,可極大程度防止食品事故發生,并具備向消費者提供食品的產地、生產加工和物流等信息查詢的能力。當食品事故發生后,可以通過流通渠道記錄迅速地回收同批食品,查究事故原因,調整現有流通渠道,讓食品繞過有問題的節點繼續流通,確保其他食品流通渠道的安全,以最大程度地減少危害擴大。未來,不排除該國將此系統的運行方式與藥品安全監管相結合,形成藥品獨有的追溯體系。
因此,本文主要圍繞美國和歐盟多國通用的藥品追溯體系建設現行成果與可借鑒之處進行探討分析。
SNI跟蹤與追溯處方藥供應鏈
對于藥品安全與風險管理,美國FDA在2005年就發布了3個相關指南文件,對已上市藥品存在的安全隱患和風險進行評估和監測:一是上市的風險評估(前期市場準則);二是藥物警戒和流行病學評價(風險管理在藥品上市后的規范做法);三是風險最小化行動計劃和應用程序。其中,常用的上市后風險最小化措施就包括藥品信息的追蹤。
早在1988年,美國制定了《處方藥營銷法案》(PDMA),要求所有藥品經營企業記錄藥品來源和銷售去向。但由于這種記錄方法存在漏洞,造假較容易,可靠性不高。因此,FDA決定采用RFID技術。
RFID技術即射頻識別技術,通過無線射頻信號自動識別目標對象并獲取相關數據,可實現對電子標簽的快速讀寫,并可對多目標和移動目標進行識別,還可以實現全球范圍內物品的跟蹤和信息的共享,從而對藥品的生產和流通進行全過程跟蹤,也稱藥品電子譜系。
FDA對該技術寄予厚望。藥品電子譜系能夠記錄藥品歷次交易時間、交易方名稱、交易地址等藥品譜系信息,滿足譜系要求的電子文檔及其系統,保護消費者免受污染藥品或假藥的危害。
2007年9月,美國現行《食品藥品管理修正法案》(Food and Drug Administration Amendments Act,FDAAA)頒布實施,其中913部分創建了《聯邦食品、藥品與化妝品法案》(Federal Food,Drug,and Cosmetic Act,FDCA)的505D部分,這部分內容要求美國衛生與公眾服務部(Department of Health and Human Services,HHS)在FDAAA頒布日期起30個月內(即2010年3月前),制定一個適用于處方藥生產商與分裝商的SNI(應用于處方藥跟蹤與追溯系統的標準化數碼標識,standardized numerical identification,SNI),對處方藥進行識別、驗證、確認、跟蹤以及追溯,用于分裝的SNI應能與用于生產的SNI進行鏈接,并且SNI應與關于這種標識的國際公認標準相一致。
2011年2月15日,美國FDA召開了關于處方藥跟蹤與追溯系統的公眾研討會,對SNI的應用進行了初次介紹。SNI是一套序列化的國家藥品編碼(serialized National Drug Code,sNDC)。sNDC由美國《聯邦規章典集》第21篇207部分闡述的“國家藥品編碼”(National Drug Code,簡稱NDC)組成,是一組獨有的序列號,由標簽編碼、藥品編碼、包裝編碼共10個字符組成。NDC由每個獨立包裝的生產商或分裝商生成,可保證一物一碼,并以條形碼的形式印刷在藥品包裝上。
圖1 sNDC示例

(注:圖片來自網絡)
如今,美國大多數的處方藥包裝已含有NDC。NDC的標簽編碼包含生產商與分銷商信息,藥品編碼包含藥品特性、劑型、配置等信息,包裝編碼包含藥品包裝尺寸與類型信息。在NDC的基礎上加上一組不超過20個字符的數字序列所形成的sNDC(SNI),可鏈接到包含藥品批號、有效期、分銷信息以及其他有關藥品標識的數據庫中,這樣便能作為識別處方藥包裝的方法,進而有助于驗證、跟蹤與追溯藥品。SNI允許制造商或分包商為每個藥品包裝分配序列號,與NDC組合可形成獨有標識,并且能夠支持數以億計上市藥品的SNI不重復。
采用sNDC作為大多數處方藥的SNI,還要滿足FDCA的505D(b)(2)中部分關于“SNI應統一、可行,可在國際范圍內認可”的要求。據FDA介紹,sNDC可與GTIN實現兼容,可創造出一個序列化的GTIN(sGTIN)。GTIN是由國際標準1(Globe standard 1,簡稱GS1)建立的藥品標識全球標準,GS1是以協商一致為基礎、非盈利性的國際標準組織,GS1系統是世界上最被廣泛使用的供應鏈標準系統。GTIN可被用于整個供應鏈包裝的獨有標識。
圖 2 處方藥跟蹤與追溯系統的運行情況
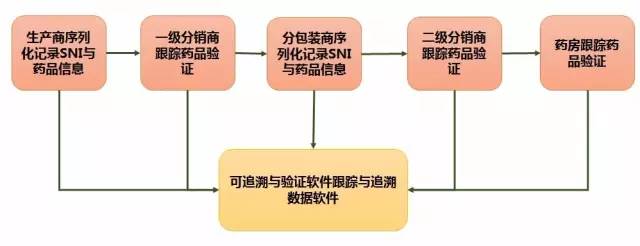
(注:圖片根據公開資料整理)
對于適用于藥店或其他藥品售貨機的零售商來講,處方藥包裝是生產商或分裝商在進行州際貿易時的最小單位。如果生產商的最小市售包裝單位是6盒藥品,那么一個SNI就為裝有6盒藥品的容器包裝的標識。單盒藥品不需要SNI,生產商通過使用序列化軟件序列化NDC,自動生成sNDC(SNI),然后運用存儲追蹤與追溯信息的數據軟件,記錄SNI與藥品信息,并通過數據載體技術(RFID、二維條碼等)將裝有6盒藥品容器包裝上的SNI與存儲追蹤和追溯信息數據庫中的藥品信息進行鏈接。
當裝有6盒藥品的容器到達一級分銷商時,一級分銷商通過標簽掃描器掃描SNI標簽以及運用可追溯與驗證軟件跟蹤藥品,驗證SNI與供應鏈參與者合法與否。然后運用存儲追蹤與追溯信息的數據軟件,記錄SNI與交易信息。到達分包裝商時,在進行一輪類似的驗證后,分包裝商要打開容器單獨銷售每盒藥品,其不但要確保每盒藥品都有合適的標簽,同時還要確保每盒藥品新包裝上必須有一個獨有的SNI。分包裝商通過使用序列化軟件序列化NDC,自動生成SNI,然后運用存儲追蹤與追溯信息的數據軟件,記錄SNI與藥品信息。
分包裝商還要將每盒藥品包裝的SNI與生產商的6盒藥品容器包裝的SNI相連,這樣就能查詢到關于此藥品分裝之前的任何信息。當單盒藥品到達二級分銷商時,其執行程序與一級分銷商類似。當單盒藥品到達藥房時,藥房工作人員也要進行與一、二分銷商類似的工作。
通過層層核驗,此系統可大幅度改善整個供應鏈的透明度與問責制,以預防偽造藥品、轉移藥品、被盜藥品以及其他不合格藥品進入藥品供應鏈;在藥品不應出售給最終消費者的情況下,執行逆向物流(例如召回,藥品缺陷等),通過收集藥品位置與持有人信息,使召回變得更快更容易;可確定藥品何時進入供應鏈,何時離開供應鏈的替換時間,從而與供應鏈合作伙伴達成更好的溝通。
低成本“配藥點驗證”成效良好
2011年7月,歐洲議會和歐盟理事會通過了《歐盟反偽造藥品指令》(The EU Falsified Medicines Directive,DIRECTIVE2011/62/EU),明確要求為歐盟境內流通的每一份藥品建立“可供驗證其真實性”的安全檔案,并建立一個歐盟國家通行的數據庫,儲存藥品安全信息。該法案的頒布為歐洲藥品電子監管系統的實施奠定了法律基礎。
歐洲藥品電子監管系統利用“二維矩陣碼”對單件藥品進行賦碼,采用“配藥點驗證”模式,通過強制實行發藥前監管碼信息驗證,以實現對藥品的安全監管及流向追溯的系統。運行多年,該模式在歐洲各國受到廣泛認可,目前在各國已基本實現全面覆蓋。
起初,歐洲多國各自的藥品電子監管系統并沒有一個統一的編碼標準。其中,英國以及許多中歐、東歐國家采用的是國際公認的EAN代碼,該代碼由各國的GS1s分部機構管理;包括瑞士在內的多數北歐國家則使用由北歐物品編碼局(Nordic article number office)統一管理的Nordisk Vare碼;另一些歐洲國家則構建了本國獨有的編碼結構。此外,各國要求的編碼放置方式也不盡相同,使一些藥品生產企業為符合歐洲各國的編碼要求,不得不在其藥品包裝上粘貼或印刷6~7種不同的藥品編碼,這大大增加了制造成本并加大了追溯難度。
因此,歐洲制藥工業協會聯合會(European Federation of Pharmaceutical Industries and Associations,EFPIA)于2006年2月聯合藥品供應鏈中各利益相關集團,著手建立一套在歐洲范圍內通行的藥品電子監管系統,即歐洲藥品驗證系統(European Medicines Verification System,EMVS)。基于成本-效益最大化的理念,EMVS選擇國際通用的二維矩陣碼(2D Data Matrix Code)作為其信息載體,采用“配藥點驗證”(Point-of-Dispense Verification)的運行方法,由藥品供應系統中的各利益相關者共同管理。
歐盟于2008年9月成立了專門的EMVS系統指導委員會。該委員會由歐洲制藥工業協會聯合會(EFPIA)、歐洲藥房聯盟(PGEU)和歐洲藥品批發企業聯盟(GIRP)作為正式成員,歐洲仿制藥商聯盟(EGA)作為觀察員,4個機構共同組成。各機構分別代表原研藥商、藥房、藥品批發企業和仿制藥商的利益,共同對EMVS的推行事宜進行指導和決策。
相對均衡的機構設置,有效平衡了各大集團的利益,有利于藥品電子監管制度的積極推行。此外,在EMV系統指導委員會的指導和協助下,歐盟還將建立歐洲藥品驗證組織(European Medicines Verification Organisation,EMVO)。該組織的主要任務是建立和管理歐洲藥品編碼中心(the European hub)。歐洲藥品編碼中心是藥品生產商和平行進口商的數據傳輸門戶,歐盟境內所有生產商和平行進口商統一通過該中心上傳或驗證藥品信息;其下接若干國家系統或國家藍圖系統。
圖3 歐洲藥品電子監管系統執行機構
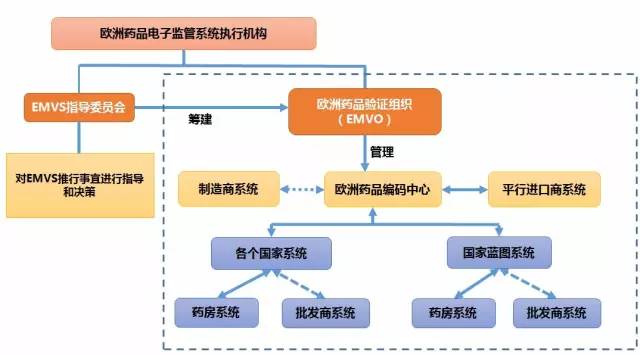
(注:圖片根據公開資料整理)
藥品生產商必須在藥品出廠前將儲存藥品信息的二維矩陣碼印在每盒藥品的次級包裝上,即與藥物直接接觸的包裝組件上。根據《歐洲藥品包裝編碼指南》(European Pack Coding Guidelines Specification),二維矩陣碼編碼結構必須符合GS1標準,并包含下列藥品信息:該藥品的全球貿易項目代碼(Global Trade Item Number,GTIN)、藥品序列號、藥品過期日和藥品批次。其中,藥品序列號是電子監管系統識別藥品的重要標識,要求互不重復。此外,為防止造假者按規律推算藥品序列號,其生成過程完全隨機,且須在藥品超過保質期7年后其序列號才能被重復使用。賦碼完成后,生產商需要通過掃描條碼完成藥品與序列號的相互關聯,并將編碼信息發送至歐洲藥品編碼中心數據庫。
藥品供應鏈中的其他參與者(如批發商)在取得系統認可后,可自愿在任何時候通過掃描藥品包裝上的二維矩陣碼發出驗證請求,以確認藥品信息。另外,EMVS指導委員會計劃在EMVS系統運行的第二階段,由藥品分銷商通過已有數據交換網絡添加相關信息,進而建立藥品全程追蹤系統。
以醫院藥房和零售藥店為主的藥品銷售商在追溯系統中扮演著十分重要的角色。根據《歐洲藥品驗證系統實施階段信息傳輸要求》(European Medicines Verification System-Implementation Phase:Request for Information)的規定,藥劑師在發售藥品前,須先掃描藥品包裝上的二維矩陣碼。經掃描,系統會將檢測到的藥品信息與中心數據庫中的信息相對比。如果掃描到矩陣碼中的信息與數據庫中的信息相符,并且滿足其他標準(如“藥品在保質期內”和“藥品不在召回范圍內”),藥劑師可將藥品發售給患者,此數據庫中的藥品狀態自動改為“已發售”。如果掃描到矩陣碼中的信息與數據庫中的信息不相符(如顯示“數據庫中不存在該序列號”)或者該序列號所代表的藥品狀態為“已發售”,則說明該藥品有可能是假藥。這時,藥劑師應拒絕將該藥品發售給患者。此后,系統會自動向該藥品的制造商發出假藥警報。
與美國不同,歐洲境內各國經濟發展水平差異較大,在一些經濟發展相對落后的國家,過高的運行成本將成為推行藥品電子驗證系統的巨大阻力。而“配藥點驗證”模式并不對藥品進行全程追蹤,而是先由生產企業對藥品進行賦碼,再由藥劑師在銷售前對藥品的真實性進行驗證,省去了批發商驗證環節。
成本低、效率高、推行較容易,符合歐洲藥品安全監管執行的實際特征。除國家資金投入外,僅生產商和零售商需要為該制度的實施投入資金,流通企業尚無需投入。
為確保歐洲藥品電子監管系統能有效保障用藥安全,EMVS指導委員會在斯德哥爾摩試點中對該系統的上述兩項功能進行了測評。該測評分別將數據庫內不存在的藥品(代表假藥)、需召回的藥品和過期藥品三種問題藥品投入到供應鏈中,每種各250份。EMVS系統準確無誤地檢測出三種各250份問題藥品,檢測準確度均為100%。此外,在檢測到假藥后,EMVS系統能準確向代表生產商的終端發送偽造藥品警報信息;在檢測到待召回藥品和過期藥品后也能及時向藥劑師發出警報,提醒藥劑師勿將藥品發售給患者。EMVS具有較好的實施效益,該系統在假藥、待召回藥品和過期藥品檢測方面極高的準確率和靈敏度,可為該系統的全面推廣和藥品安全提供有力保障。
圖4 歐洲藥品驗證系統運行模式示意圖
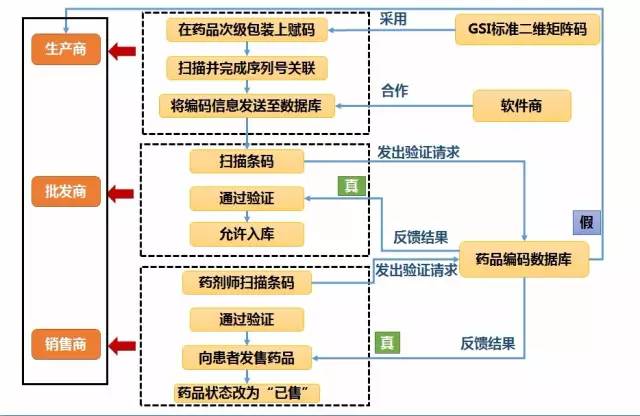
(注:圖片根據公開資料整理)
信息來源:上海醫藥商業行業協會
|