2015年藥品檢查報告:風險管理原則被多次提及,飛檢發現中藥飲片走票過票
日期:2016/6/8

6月3日,CFDI(CFDA食品藥品審核查驗中心)發布了《2015年度藥品檢查報告》,全面回顧了2015年藥品GMP認證檢查、注冊生產現場檢查、GMP跟蹤檢查、中藥材GAP認證檢查、進口藥品境外生產現場檢查、飛行檢查及國際觀察檢查情況。
2015年,總局核查中心組織開展藥品GMP認證檢查、注冊生產現場檢查、GMP跟蹤檢查、中藥材GAP認證檢查、進口藥品境外生產現場檢查、飛行檢查及國際觀察檢查共計 698家/次。其中,GMP檢查(藥品GMP認證檢查和藥品GMP跟蹤檢查)占據了檢查任務的50%以上的份額。
表1 2015年完成各類藥品檢查任務一覽表
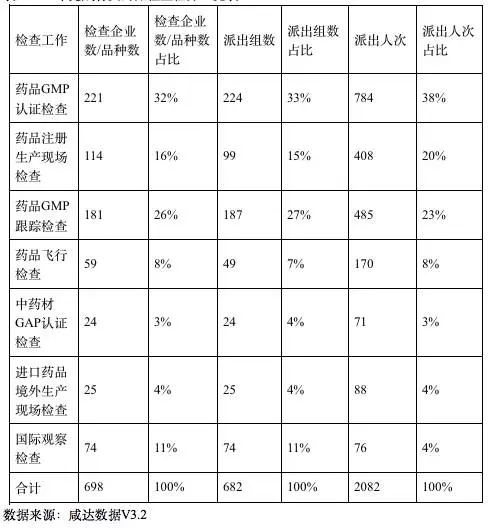
根據報告,藥品GMP認證檢查數量較前兩年減少,全年共安排檢查224家/次,接收現場檢查報告236份,完成審核件221份,其中212家藥品生產企業通過藥品GMP認證檢查,9家藥品生產企業未通過藥品GMP認證檢查,占4.1%。整改復核檢查和發放告誡信的企業較前兩年比例明顯上升,整改復核檢查17家占7.7%,發出告誡信的企業68家,占13. 1%。發告誡信最多的省份是江蘇、湖南和四川。
從2015年GMP申請認證的劑型包括大容量注射劑、小容量注射劑、凍干粉針劑、粉針劑、疫苗類產品、血液制品等可以看出,在2013年12月31日以后,仍是有生產廠家繼續認證血液制品、疫苗、注射劑等無菌藥品。(注:2013年12月31日以前此類藥品的生產廠家若沒有通過2010年版GMP認證將面臨停產)
根據報告可知,認證檢查的企業中相當一部分是經歷搬遷或異地改造后申請認證的,但其在申請認證檢查中并沒有選擇風險高、工藝復雜的品種動態生產,而是選擇風險最低、工藝最簡單的品種,甚至選擇氯化鈉注射液、葡萄糖注射液等品種,并不能代表其人員、設施設備與質量體系運行的最差條件,使得在短暫的現場檢查中問題的發現和風險的識別帶來一定的局限性。另一方面,新轉移來的大多數品種在認證檢查時沒有完成工藝驗證,同樣使得認證后的風險加大、認證后的日常監管壓力加大。總局核査中心為此加大了告誡力度,告誡信的問題大多集中于此。
設備方面發現主要缺陷較少,目前缺陷主要集中在設備維護保養,計量設備的校準等方面,這也說明藥品2010年版GMP實施以來,我國藥品生產企業設備的更新換代較為徹底,企業也較為重視。
雖然在我國GMP認證檢查工作已經在2016年下放至省局,為使認證檢查局限性帶來的風險降到最低,2016年總局檢查中心將進一步加大跟蹤檢查力度,將以往以劑型為主線的檢查模式逐步回歸到以品種為主線的檢查模式,基于風險、基于企業過往的認證檢查情況,以問題和風險信號為導向,有針對性的開展檢査。
2015年藥品GMP跟蹤檢查計劃271家/次,主要為注射劑、預防類生物制品(疫苗),同時涵蓋口服固體制劑、體外診斷試劑、原料藥等。此外,2015年選取胸腺肽類產品生產企業作為針對生化藥品行業進行跟蹤檢查。在121家胸腺肽類藥品生產企業中,其中99家停產或不具備生產條件,實際共對22家企業實施了藥品GMP跟蹤檢查。
無論是GMP認證檢查還是跟蹤檢查,風險管理原則被多次提及,這可以體現出總局檢查中心在吸收美國FDA的經驗:美國FDA并不將檢查過程中發現的所有問題均作為最終缺陷項,檢查員根據發現的問題結合對產品的風險進行判斷后形成最終缺陷項,并在召開檢查末次會時書面告知企業。
2015年總局檢查中心共對114個品種(規格)進行藥品注冊生產現場檢查,包括化學原料藥31個、化藥制劑56個、中藥8個、生物制品15個、血液制品4個,涉及片劑、膠囊劑、顆粒劑、溶液劑、軟膏劑、外用凍干制劑、丸劑、原料藥、口服溶液劑和注射劑共9個劑型。
在藥審中心2015年發出的123個注冊生產現場檢查任務中,企業提交申請93個,占76%;當年開展現場檢查69個,占申請數量76%,企業撤回注冊申請及現場檢查的10個,占申請數量11%;臨床自查品種9個。對4個品種開展有因核查,其中2個釆取飛行檢查模式。
各省注冊生產現場檢查數量可以從側面體現各省的注冊現狀,江蘇省注冊生產現場檢查數量最多,共16個;其次是廣東省11個;再次是山東省10個。
2015年總局檢查中心共派出49個檢查組對59個企業進行了飛行檢查, 其中銀杏葉提取物及制劑5個組8家企業,中藥飲片14個組19家企業,中藥提取物1個組2家企業,中藥制劑6個組6家企業,生化藥品8個組8家企業,化學原料藥8個組9家企業,化學藥制劑6個組6家企業,血液制品1個組1家企業。
接受飛行檢查的59家企業中,現場檢查通過的19家;不通過的39家;1家待處理。對不通過的39家中的37家采取了處理措施,其中22家被收回藥品GMP 證書,6家被吊銷藥品生產許可證,3家立案查處。
值得注意的是中藥飲片在飛行檢查中發現走票過票問題,為不法分子的經營活動提供便利,部分企業為藥販子或經營企業生產、銷售假藥提供便利,并且虛開票據,使其合法化,導致大量無法保證質量的中藥飲片流入市場。
自2011年起,總局檢查中心共68個檢查組前往20個國家對73個品種進行了檢查。前3年檢查暴露出境外企業不重視我國藥品相關法律法規、不按照我國要求組織生產、對出口我國和出口其他國家的產品區別對待等問題。自2014年起,總局檢查中心檢查數量逐年加大,力求檢查覆蓋更加全面。對產品進口量大、注冊量多及藥品合規性風險較高的國家和地區進行重點檢查。
2015年共34個品種列入了現場檢查任務,總局檢查中心已完成檢查25個品種,3個品種的生產企業明確表示不接受或故意拖延檢查,另有6個品種因外事或審評等原因推遲至2016年檢查。
值得注意的是德國某公司的某植物藥固體制劑變更用藥人群未及時申報被點名。原注冊申報說明書的適用人群為成人、0-6歲和7-12歲兒童。2007年8月德國當局重新頒發上市銷售許可證書時調整用藥人群為12歲以上成人(原因:某成分容易導致兒童過敏),但企業于2008年提出再注冊申請時仍沿用原用法用量。
根據總局國際會作司來函要求,總局檢查中心組織藥品GMP檢查員參加各類國際藥品GMP檢查觀察工作。2015年完成觀察74次,包括批準前檢查、跟蹤檢查和飛行檢查等不同類型。檢查內容方面,盡管不同藥品GMP檢查機構檢查的重點存在一定的差異,但對質量控制與質量保證、物料與產品、 生產管理、確認與驗證的關注相對比較高。
2015年國外監管機構GMP檢查的觀察任務渉及浙江、上海等18個省市,其中浙江、上海、 廣東、江蘇、河北、山東占全部任務量的17%。浙江22個觀察任務占據30%全國最高。

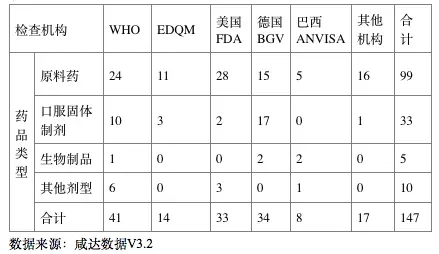
國際藥品GMP檢查觀察中涉及到的藥品包括原料藥、口服固體制劑、生物制劑、吸入劑、醫藥中間體、診斷試劑、膳食補充劑等147個產品。在147個檢查的產品中,包括99個原料藥的檢查,33個口服固體制劑的檢查,5個生物制劑的檢查。
74次檢查觀察中,檢查范圍包括原料藥的檢查次數共54次,約占全部檢查次數的73%,可見我國的出口項目主要還是以原料藥為主。檢查范圍包括口服固體制劑的檢查次數10次,約占全部檢查次數14%。
檢查的企業包括69家,其中國有企業16家,三資企業25家,私營企業28家。
表2 接受國際檢查的不同類型藥品分布情況
信息來源:上海醫藥商業行業協會
|