一藥企被立案,CFDA發文警告全體企業!
日期:2016/9/19
來源:賽柏藍 作者:司徒陽明
昨日(9月18日),國家食藥監局總局發布兩則公告。一則是對吉林省長源藥業有限公司飛行檢查情況的通報,一則是《總局加大生化藥原輔料飛檢力度 長源藥業GMP證書被收回》的消息。
非比尋常的是,國家局在發了飛行檢查的通報之后,又單獨發了一則消息,顯見國家局對此事件的重視,而通過這個不同尋常的舉動,國家局想傳達和強調的是:本次飛行檢查是對全行業,特別是生化藥生產企業的一次警示和鞭策。
警示和鞭策的是什么呢?企業們,原料和輔料不可忽視啊!
此次被查的重點是生化藥,倒下的也是生化藥企,但是對于全行業來收,原料、輔料必須重視,國家局已經在敲響警鐘了,再強調一次,萬萬不可忽視!
需要怎么做呢?國家局在新聞稿中也做出了明確:加強了供應商審計和供應鏈管理。
該企業已經被立案
9月18日,國家食品藥品監督管理總局發布公告,飛行檢查中發現吉林省長源藥業有限公司在腦肽膠囊、復方腦蛋白水解物片生產中違反《中華人民共合國藥品管理法》及藥品GMP相關規定,決定封存庫存藥品,收回該企業藥品GMP證書,責令召回已銷售產品,對企業違法違規生產行為立案調查。
食品藥品監管總局新聞發言人指出,當前個別生化藥企業存在原輔料供應鏈管理問題,一方面要加快有關生產規范研究與制定;另一方面需要進一步加強監督檢查,進一步督促企業持續合規生產。生化藥企業必須重視上游原輔料供應商審計,加強供應鏈管理,切實承擔起藥品質量主體責任。
隨機抽查中發現
按照工作部署,6月中旬總局組織核查中心對生化藥開展隨機抽查時發現了一生產企業提取后成分還流向了吉林省長源藥業有限公司等藥品生產企業,總局當即決定開展延伸檢查。經過對該公司生產的腦肽膠囊、復方腦蛋白水解物片等飛行檢查發現該企業存在改變豬腦提取工藝、編造記錄、擅自使用豬腦干渣直接投料等違法違規行為,違反了《中華人民共合國藥品管理法》及藥品GMP相關規定。
總局要求吉林省食品藥品監管局監督企業封存其庫存腦肽膠囊,收回該企業《藥品GMP證書》,責令企業召回已銷售產品,對企業違法違規生產行為立案調查。
此次被披露只有吉林省長源藥業一家,但是,從國家局的表述來看,應該還有其他企業,流向的不止這一家。
供應商審計和供應鏈管理是重點
需要指出的是,近年來大多數企業已經加強了對原輔料的質量控制,加強了供應商審計和供應鏈管理。但還有個別藥企業對原輔料管理沒有給予足夠重視,供應商審計走過場,沒有建立起真正的供應鏈質控體系。更有甚者,為了節省原料成本存在改變工藝,記錄造假,違規投料等問題。
本次飛行檢查是對全行業,特別是生化藥生產企業的一次警示和鞭策。
今年10家藥企因原輔料問題被收GMP
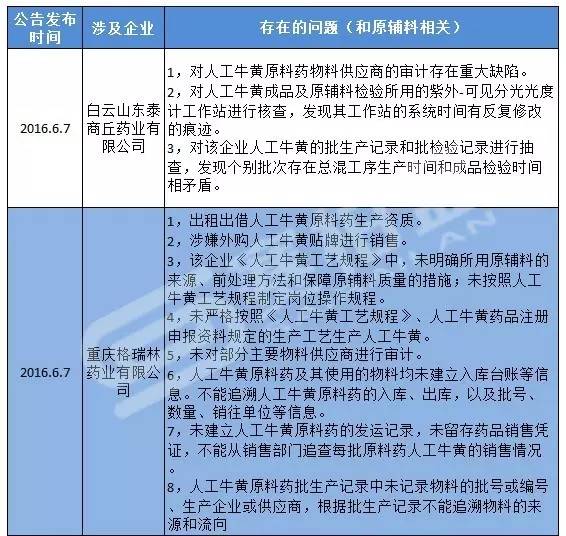
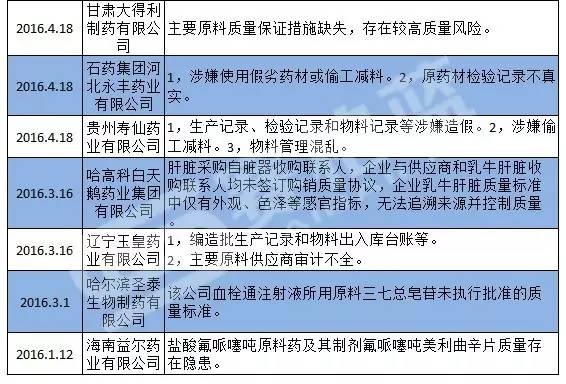
從國家食藥監總局發布飛檢通告來看,今年國家食藥監總局總共發布了對19家藥企飛檢公告,其中涉及到原輔料問題有10家被披露原輔料存在問題,占比超過了一半以上.
由此可見,原輔料問題已經是高發難題,而國家局特意就此發通知也算是可以理解。下面是筆者根據國家局的飛檢公告整理出來的,因為原輔料問題被收GMP證書企業及其原因列表。
對于原輔料問題可能存在什么哪些問題,企業可以對照著做下自我檢查,及時調整,努力做到合規。
信息來源:賽柏藍
|