2016年中國醫藥行業十政談(收藏版)
日期:2016/12/15
年關將至,我們奉上影響中國醫藥行業,乃至全民健康未來的十大政策梳理,上至頂層設計,下至行業監管。你一定要知道它們,而且要了解前后的語境以及未來走勢。
過去說“政策大年”是個偽命題,因為永遠有新的政策出臺,指揮棒的方向也會不斷調整。
但2016年對于整個中國醫藥行業來說,必將是被歷史銘記的一年。醫跟藥,不論是從提供方生產和流通企業,還是到使用方的醫院和患者,都隨著監管方的大力度整治經歷著切身的變革。

9月29日,人社部引沸了整個醫藥界,在這一天重磅文件《2016年國家基本醫療保險、工商保險和生育保險藥品目錄調整方案(征求意見稿)》,明確提出2016年底前將完成本輪醫保藥品目錄調整工作。
這次調整距離上次已經有7年之久了,對很多意欲進入醫保的企業來說,簡直望穿了秋水。此次醫保目錄調整方案較以往最大的不同之處在于,在調整內容方面以CFDA注冊數據為基礎,不接受企業申報或推薦,不收取評審費用和其他各種費用;在藥品遴選方面,分為咨詢專家和遴選專家,總共20400位專家,專家團成員數量前所未有的強大。
當然,醫保目錄要調整,怎么可能納下醫保支付標準?按照各路人馬匯集的各路資料顯示,基本醫療保險藥品支付參考價的調整也會在今年12月與醫保目錄“孿生”。醫保支付價的調整也是一個孕育良久的政策,原計劃2015年9月出臺,今年2月又傳出6月出臺,但到現在還未出臺。不過,各地倒是勇敢出臺,安徽、浙江、福建等不少省份明確了支付價標準。
反正這次的醫保目錄調整和醫保支付價調整都很玄妙。藥品調入調出成為了謎之存在,企業在各種場合豎起了耳朵,期許聽到些什么。在10月12日,人社部召開的座談會上,原定只有十幾家企業參與的座談會,最后來了三百多人,按照參會人士的說法,“消息稍微靈通一點的企業都來了,誰也不想錯過這個機會。”
于是小道消息更新得比馮大輝還勤,有的說此次醫保品種會增加15%,預計300款藥品進入,一大批企業受益。也有人說,醫保目錄調整,萬億市場格局將改寫。總之,無論醫保目錄和醫保支付價標準何時出來,這都將是影響醫藥企業大到不能再大的大事了。
4月23日,在山東濟南非法經營疫苗系列案件爆發不到一個半月之后,國務院公布了關于修改《疫苗流通和預防接種管理條例》的決定。
相較于老版規定,新版《疫苗流通和預防接種管理條例》取消了疫苗批發環節,尤其是改革了二類疫苗的流通方式,明確將疫苗的采購全部納入省級公共資源平臺,第二類疫苗由省級疾病預防控制機構組織在平臺上集中采購,由縣級疾病預防控制機構向疫苗生產企業采購后供應給本行政區域內的接種單位,不再允許藥品批發企業經營疫苗。
同時新版條例也強化了疫苗全程冷鏈儲存運輸管理制度,明確配送責任,強化儲運的冷鏈管理。新版條例實施之后,疫苗全程追溯制度也即將建立。條例規定,相關企業和單位應記錄疫苗流通、使用信息,實現疫苗最小包裝單位的全程可追溯。對包裝無法識別、來源不明等情形的疫苗,如實登記并向藥品監管部門報告,由監管部門會同衛生主管部門監督銷毀。
事實上,國家食藥監總局對于藥品流通領域的監管一直在進行,5月3日,CFDA出臺《關于整頓藥品流通領域違法經營行為的公告》,各省陸續開展藥品流通企業整治行動,嚴查藥品購銷環節的“證、票、賬、貨、款”,飛行檢查頻次大幅增加,上百家企業GSP證書被撤銷或收回。

2016年,兩票制成為了醫藥流通領域中最為火熱的關鍵詞。12月2日,一份《重慶市公立醫療機構藥品采購“兩票制”實施方案(試行)》(初稿)的文件流出,也標志著繼福建、安徽、陜西之后,又一地區公開兩票制實施細則。
所謂兩票制,即規定藥品生產企業到流通企業開一次購銷發票,流通企業到公立醫療機構開一次購銷發票,旨在規范藥品流通環節,并通過減少流通環節來降低虛高藥價。根據《關于印發深化醫藥衛生體制改革2016年重點工作任務的通知》要求,今年綜合醫改試點省份要在全省范圍內推行“兩票制”,目前已達到11個省份。
從目前已經公開細則的省份來看,不同地區執行兩票制的特點也不盡相同。陜西兩票制方案規定醫療機構主導遴選配送商,并且限定配送公司數量,三級醫院藥品和耗材各15家以內,二級醫院藥品5家、耗材15家以內,極大的壓縮的當前醫院商業的開戶數量。而福建規定則更為嚴厲,廠家只能指定一家配送公司負責一個地區的配送。重慶兩票制規定則將藥品批文持有者委托生產的情況視為生產企業,在福建、安徽、陜西、寧夏、四川的基礎上做了大膽突破。
多票制時代,藥品流通市場背后的代理、分銷、配送關系錯綜復雜,推行兩票制甚至是一票制無疑難度巨大,但就目前來看,多地明確兩票制方案釋放出來了改革勢在必行的信號。

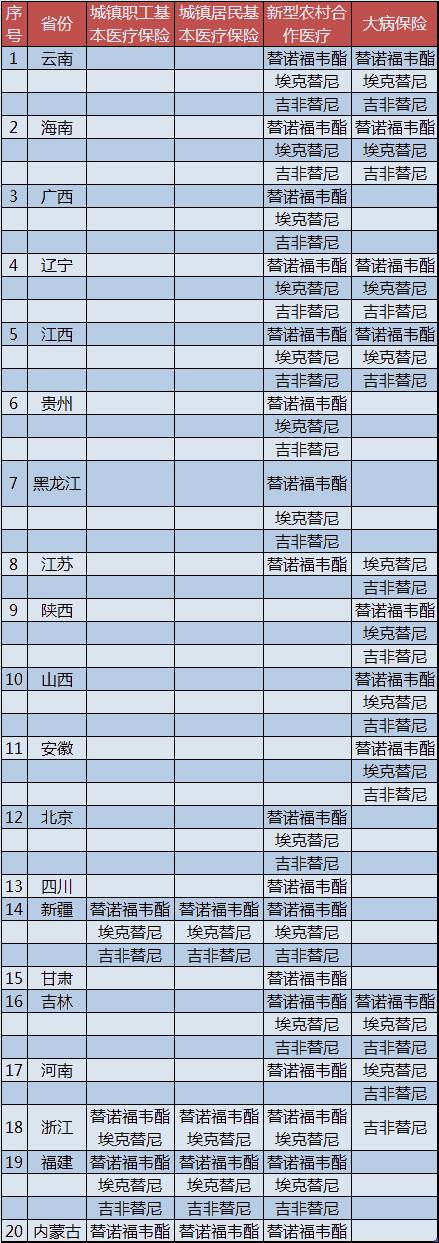
5月20日,衛計委連發《國家藥品價格談判有關情況說明》、《國家藥品價格談判取得重要進展和成果》、《關于做好國家談判藥品集中采購的通知》、《國家衛生計生委辦公廳關于公布國家藥品價格談判結果的通知》四文,就首批國家藥品價格談判涉及的五個藥品談判情況進行了通報,替諾福韋酯、埃克替尼、吉非替尼3種談判藥品降價幅度分別為67%、54%、55%。這是中國首次通過國家談判機制對高價新藥降價。
對于參與國家談判的企業來說,以價換量后與醫保銜接的確實落地是其最關注的問題。事實上,為了更好地將談判藥品落地,衛計委在《國家藥品價格談判有關情況說明》中,配備了四條重要的措施。而且在《國家藥品價格談判有關情況說明》中,還為談判藥品在各地的落地制定了時間周期,要求各地要在6月底前完成談判藥品集中掛網。
而在談判結果公布5個月之后,10月14日,衛計委發布《關于做好國家談判藥品與新型農村合作醫療報銷政策銜接的通知》,重點落實“做好國家談判藥品與新型農村合作醫療報銷政策銜接有關工作”。截至11月18日,有20個省份將談判藥品納入各類醫保合規費用范圍。
如何讓藥價談判不變成空談,未來相關支持政策能否到位將至關重要。此前,人社部發布《2016年國家基本醫療保險、工傷保險和生育保險藥品目錄調整工作方案(征求意見稿)》,提出對經遴選程序確定的談判藥品通過提請咨詢專家重點考慮來進行對接,這也被認為有可能使國家談判藥品真正實現落地。而未來,這種談判機制被認為將有持續化的可能。
2015年7月22日,CFDA發布《國家食品藥品監督管理總局關于開展藥物臨床試驗數據自查核查工作的公告》,公布了1622個需要自查核查的品種,掀起了一場行業整頓大風暴。最終的數據顯示,1622個需進行自查核查的品種中,有1193個申請主動撤回,30個不予批準,193個免臨床,而剩下的206個臨床申請需進行臨床數據現場核查。
2016年3月30日,CFDI發布《藥物臨床試驗數據現場核查計劃公告(第1號)》,截至目前,總局先后發布了8批次現場核查公告,所涉及產品數量215個。
繼臨床試驗數據領域展開自查核查之后,8月11日,CFDA發布《關于開展藥品生產工藝核對工作的公告(征求意見稿)》,針對2007年前未按照批準的生產工藝組織生產、改變生產工藝不按規定研究和申報的批準上市的品種,總局決定開展藥品生產工藝核對工作。此舉引發行業軒然大波。
但從CFDA最近的表態來看,生產工藝自查核查似乎并不會像“722“那般嚴厲。CFDA副局長吳湞表示,生產工藝自查目的是固定企業生產工藝,總體而言目前工藝執行情況還較好,但有些產品,例如中藥注射劑、多組份的生化制劑等工藝,確實存在風險問題。
8月19日至20日,在全國衛生與健康大會上,習近平強調,沒有全民健康,就沒有全面小康。要把人民健康放在優先發展的戰略地位。8月26日,習近平主持召開中共中央政治局會議,審議通過“健康中國2030”規劃綱要。綱要明確了“健康中國”的5個重點:普及健康生活、優化健康服務、完善健康保障、發展健康產業和建設健康環境。
“健康中國2030”規劃綱要是今后15年推進健康中國建設的行動綱領,將國家醫療、醫藥產業建設提升到了國家頂層設計層面,是指明未來健康政策和產業發展方向的最高指導原則,也是我國積極參與全球健康治理、履行我國對聯合國“2030可持續發展議程”承諾的重要舉措。
作為“十三五“的開局之年,“健康中國2030”跨越三個五年,對政策、產業的發展具有前瞻性的戰略意義,是國家對醫療、醫藥以及泛健康領域的長期布局。

2月22日,國務院印發了《中醫藥發展戰略規劃綱要(2016-2030年)》。這也是2016年開年以來,國家層面出臺的第一份關于中醫藥發展的重磅文件。根據發展規劃綱要,到2020年,要實現人人基本享有中醫藥服務,到2030年,中醫藥治理體系和治理能力現代化水平要有顯著提升,并使中醫藥服務領域實現全覆蓋。
在2015、2016年兩年,中醫藥產業領域各級政策密集發布,例如《中華人民共和國中醫藥法(草案)》,這一自1983年便開始提議的中醫藥法終于步入實質性階段,目前已進入二審階段;由國家中醫藥管理局印發的《中醫藥十三五規劃》,則是中醫藥行業首次被提升至“國民經濟重要支柱性行業”的地位。而隨著《中藥配方顆粒管理辦法(征求意見稿)》以及取消中藥材生產管理規范(GAP)認證的出臺,中醫藥產業發展的細則也得到進一步落實。
但不可否認的一點是,從整體來看,中醫藥資源總量仍然不足,尤其是基層中醫藥服務能力薄弱、高層次人才缺乏,野生中藥材資源破壞嚴重,產業集中成都也較低。這些都將影響中醫藥可持續發展。

2015年9月11日,國務院辦公廳發布《國務院辦公廳關于推進分級診療制度建設的指導意見 》,指出推進分級診療制度的目標:到2017年,醫療衛生機構分工協作機制基本形成,優質醫療資源有序有效下沉,以全科醫生為重點的基層醫療衛生人才隊伍建設得到加強等。到2020年,保障機制逐步健全,合理醫療服務體系基本構建,基層首診、雙向轉診、急慢分治、上下聯動的分級診療模式逐步形成,基本建立符合國情的分級診療制度。
關于急慢分治,文件中指出,明確和落實各級各類醫療機構急慢病診療服務功能,完善治療—康復—長期護理服務鏈,急危重癥患者可以直接到二級以上醫院就診。在這一指導下,隨后在2015年12月1日,國家衛生計生委辦公廳、國家中醫藥管理局辦公室發布《關于做好高血壓、糖尿病分級診療試點工作的通知》,針對慢性病高血壓、糖尿病開始進行相關工作。
2016年8月19日,衛計委聯合國家中醫藥管理局發布《關于推進分級診療試點工作的通知》。在各地申報的基礎上,國家衛生計生委和國家中醫藥管理局確定了北京市等4個直轄市、河北省石家莊市等266個地級市作為試點城市開展分級診療試點工作。要求進一步提升基層服務能力、推進家庭醫生簽約服務、探索組建醫療聯合體、科學實施急慢分治、加快推進醫療衛生信息化建設促進區域醫療資源共享、加強部門協調完善配套政策。

4月6日,國務院總理李克強主持召開國務院常務會議,確定2016年深化醫藥衛生體制改革的第一個重點就是公立醫院改革。明確將城市公立醫院綜合改革試點城市由100個擴大到200個。開展縣級公立醫院綜合改革示范。新增試點城市公立醫院取消藥品加成,嚴控不合理檢查檢驗費用,年內實現大病保險全覆蓋。全面推進公立醫院藥品集中采購,建立藥品出廠價格信息可追溯機制。完善基層醫療機構績效工資制度,鼓勵試點城市制訂公立醫院績效工資總量核定辦法,建立與崗位職責和業績相聯系的分配激勵機制,凸顯醫務人員技術勞務價值。
5月14日,在第四屆中國縣市醫院論壇上,人力資源和社會保障部社會保障研究所所長金維剛指出,整個醫改最主要、最核心的問題在于醫療服務領域的改革,而非醫保,目前公立醫院改革不到位,導致整個醫改沒有取得實質性突破。
而整個公立醫院的改革與中國制藥行業休戚相關。“保證金事件”以及“棄標企業醫院門前散布”的消息幾次在業內爆出,公立醫院改革之難也在不時提醒所有人醫改進入深水區的含義。探索過程中,摩擦和碰撞不可避免。
5月30日,習近平在全國科技創新大會、兩院院士大會、中國科協第九次全國代表大會上發表講話。習近平強調,必須堅持走中國特色自主創新道路,面向世界科技前沿、面向經濟主戰場、面向國家重大需求,加快各領域科技創新,掌握全球科技競爭先機。習近平對醫療、醫藥的創新發展提出了具體要求:聚焦重大疾病防控、食品藥品安全、人口老齡化等重大民生問題,大幅增加公共科技供給;依靠科技創新建設低成本、廣覆蓋、高質量的公共服務體系;加強普惠和公共科技供給,發展低成本疾病防控和遠程醫療技術,實現優質醫療衛生資源普惠共享。
習近平在“科技三會”上的提出的“三個面向”為我國科技創新指明了主攻方向,對醫療、醫藥行業的科技創新、經濟發展和滿足重大醫療需求提出了戰略目標,對產業發展具有重要的指導作用。
醫療、醫藥創新是科技創新的重要組成部分,與民生問題緊密相關,對國民生活質量和國家科技水平有著舉足輕重的意義。當下醫療、醫藥市場不斷擴容,對其創新的鼓勵在經濟層面也有著相當積極的作用。工信部數據表明,在今年全國經濟增長全面放緩的態勢下,規模以上醫藥工業增加值基本維持在10%以上,高于其他工業增長。
信息來源:E藥經理人
|