獨家解讀國務院2017首發取消令:網售藥、GCP初審及藥輔審批
日期:2017/1/26
2017年剛開始,國務院就取消了三項醫藥行業省級審批:互聯網藥品交易B證、C證正式被取消;藥物臨床試驗機構資格認定初審被取消;藥用輔料省級注冊被取消。
近日,國務院印發《關于第三批取消中央指定地方實施行政許可事項的決定》,決定取消中央指定地方實施的39項行政許可事項目錄中,涉及醫藥行業的有3個重大項。分別是藥物臨床試驗機構資格認定初審、藥用輔料(不含新藥用輔料和進口藥用輔料)注冊、互聯網藥品交易服務企業(第三方平臺除外)審批。
這三個“取消”均是備受醫藥行業人士關注的熱點。那么,國務院的文件釋放了哪些信號?尤其是,在互聯網藥品交易服務領域,自第三方平臺網上售藥被叫停后,國家為何取消B證和C證的審批?藥物臨床試驗機構資格認定初審被取消,會是臨床試驗機構資格審批制轉為備案制的前奏嗎?與此同時,隨著2016年藥用輔料關聯審評方案的正式落地,此番再取消省級審批,又會迎來何種局面?
華中科技大學同濟醫學院藥品政策與管理研究中心陳昊接受E藥經理人采訪時表示:這三項省級審批的取消與國家整體的監管方向相吻合。過去省級和國家對藥品的監管在實權劃分上并不十分合理、協調。而且國內各省區的審評審批水平和發展并不均衡,監管力量水平不一,也存在地方保護等因素。
如今整個監管理念在轉變,更加強調企業是第一責任主體,更加強調依靠企業的行業自律和道德自律來實現治理,進而取消一些低風險、相對可控的省級審批,這也與國際相接軌的。而且取消行政審批并并非完全不管,而是轉變管理方式,更加強調事中和事后的監管。
國務院決定取消中央指定地方實施的行政許可事項的三個醫藥目錄
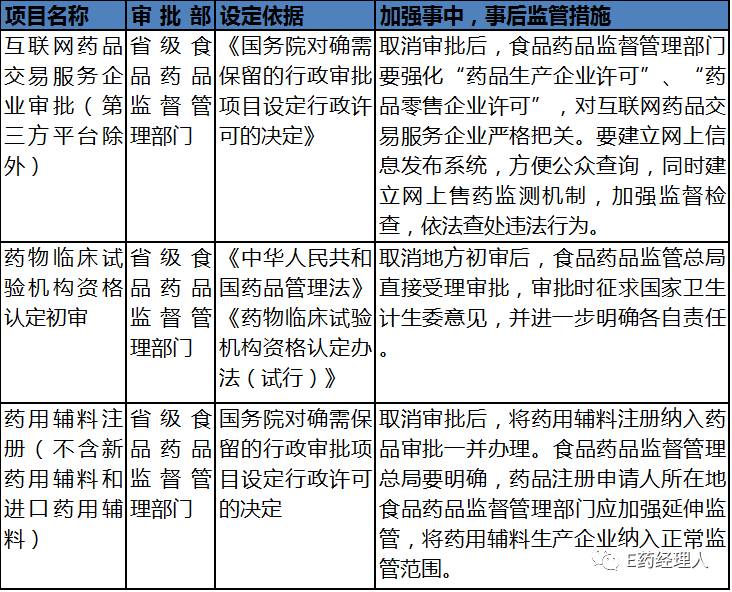
最受關注的互聯網藥品交易資格有了大變。根據國務院文件可知,互聯網藥品交易服務企業的省級審批(第三方平臺除外)被取消。這意味著,過去由各省級監管部門負責的B證和C證的審批將正式被取消,實體藥店及醫藥批發企業開展互聯網藥品交易服務不再需要通過省級食品藥品經營監督管理部門的審批。
總體來說,互聯網藥品交易服務資格證書是由國家食品藥品監督管理局(CFDA)給從事互聯網藥品交易服務的企業頒發的互聯網藥品交易服務機構資格證書,分為A、B、C三種。過去,除了A證(第三方交易平臺)由國家統一審批,嚴格監管外,醫藥B2B業務的B證和網上藥店業務的C證均由省級監管部門審批。
公開數據顯示,截至2017年1月22日,CFDA網站顯示《互聯網藥品交易服務資格證書》共830張,其中C證(向個人消費者提供藥品)649張。截至2016年12月22日,A證共37張,B證(藥品生產企業、藥品批發企業通過自身網站與本企業成員之外的其他企業進行的互聯網藥品交易)共195張。
陳昊認為,B證的服務方式主要是與其他企業進行藥品交易如藥品生產企業、藥品批發企業通過自身網站與本企業成員之外的其他企業進行的互聯網藥品交易,這屬于企業行為,風險可控,因此不需要審批。而C證的服務方式是向個人消費者提供藥品,目前僅限于自營非處方藥品。這種B2C的形式如今均是區域連鎖實體藥店向個人銷售非處方藥,因此在實體藥店就可以實現有效監管,也屬于風險可控的類別。
“B證和C證主要針對藥品零售連鎖的審批,最近幾年藥品零售藥店的連鎖化發展趨勢明顯,連鎖的比例上升很快,已經占到55%,實體藥店隨著連鎖化的進一步發展,未來比例會更高。而且大多連鎖均是跨區域、跨省區以及全國性的體系,因此涉及到互聯網售藥的監管,如果仍然省局來做的話,不利于跨區域連鎖企業在不同省區按照統一標準來實施管理。”陳昊告訴E藥經理人。
雖然B、C證將取消,但是整體的監管更加強調事中和事后管理。如文件指出:“取消審批后,食品藥品監督管理部門要強化“藥品生產企業許可”、“藥品零售企業許可”,對互聯網藥品交易服務企業嚴格把關。要建立網上信息發布系統,方便公眾查詢,同時建立網上售藥監測機制,加強監督檢查,依法查處違法行為。”
對此,陳昊表示,取消省級審批也可大大降低藥品零售企業的經營管理成本。但隨著監管思路的轉變,企業將作為責任主體,要為服務和質量把關,身上承擔的質量監管責任更加明晰,也更加重了。
在被取消的行政許可事項目錄中,藥物臨床試驗機構資格認定也備受矚目。自CFDA開展臨床數據自查核查和仿制藥質量與療效一致性評價工作以來,企業、行業對于臨床試驗基地由審批制改為備案制的呼吁空前強烈。原因在于,國內臨床試驗機構數量有限僅幾百家,尤其是大家高需求的BE試驗基地數量更少,僅100家左右。
隨著該文件的出臺,很多行業人士紛紛解讀認為這是GCP認證取消的前奏。那么企業眼巴巴的期待著的GCP認證制度真的不遠了嗎?
陳昊指出,臨床試驗基地做備案管理是大方向。但是醫療機構涉及藥監和衛生系統的多部門管理,不僅需要部門之間的意見一致,而且配套的環境和相關的政策如保險、責任認定等要成熟。而短期之內,醫療機構的首要問題是做臨床試驗的動力不足,監管方面對臨床試驗的風險管理的成熟度也不足夠。因此,臨床試驗機構認證放開沒那么快,短期不太可能轉向備案。
他還表示,目前國家有臨床試驗基地資格的大多是省級或部級等級別較高的醫療機構,過去省局對于GCP基地的現場審查更多是受國家局委托進行的形式審查。如今隨著臨床試驗電子數據采集系統的逐漸成熟和審批文件實現標準化后,文件的申請和審批會更高效、方便,工作量也不大,放到國家局管理不是問題,不需要更多的形式審查。
取消藥用輔料的省級注冊(不含新藥用輔料和進口藥用輔料)也是其中之一。自2016年8月CFDA發布《關于藥包材藥用輔料與藥品關聯審評審批有關事項的公告》之后,藥用輔料和包材與藥品的關聯審評政策塵埃落定。但是政策的落聽還存在一些現實的操作難題,其中省級藥監部門對于輔料的審批就是其中之一。因此,此次取消藥用輔料的省級審批,也為關聯審評的實施掃清了道路。
陳昊表示:“目前國家對于藥用輔料的管理強調做DMF管理和關聯審評,將輔料與藥品審批一并辦理,如此審批部門就沒有必要再做單獨的審批。”
根據國務院文件:“取消后的國家對于藥用輔料的事中,事后監管措:取消審批后,將藥用輔料注冊納入藥品審批一并辦理。食品藥品監督管理總局要明確,藥品注冊申請人所在地食品藥品監督管理部門應加強延伸監管,將藥用輔料生產企業納入正常監管范圍。”
信息來源:E藥經理人
|