宋主任解讀《藥品經營質量管理規范現場檢查指導原則》(二)
日期:2017/6/24

設施與設備*04301
? 企業應當具有與其藥品經營范圍、經營規模相適應的經營場所和庫房。許可證注冊地址,包括輔助用房和辦公用房
〈解讀〉
1、應有與經營規模相適應的經營場所(即)。
2、經營場所應明亮、整潔。
3、經營場所應包括:總經理室、人事、財務、業務、質量等各主要部門。
4、藥品零售連鎖企業委托批發企業藥品配送,可不設庫房。
設施與設備*04601
? 庫房的規模及條件應當滿足藥品的合理、安全儲存,便于開展儲存作業。
〈解讀〉
1、庫房面積應與經營規模相適應,面積不低于1000平方米。
2、經營冷藏、冷凍藥品的,單個冷庫面積不低于50平方米。
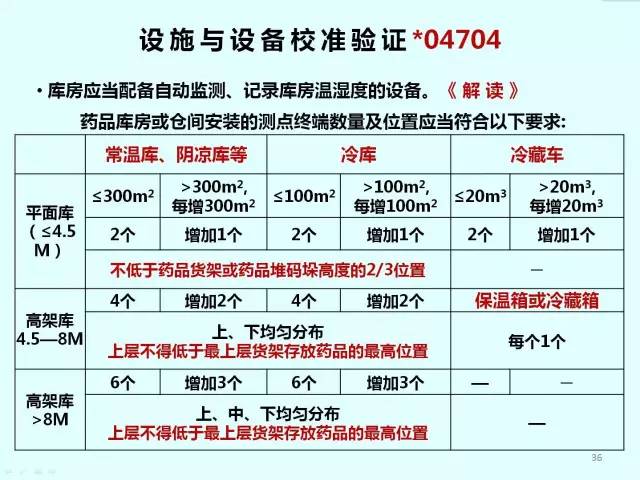
設施與設備*04704
? 庫房應當配備自動監測、記錄庫房溫濕度的設備。
〈解讀〉
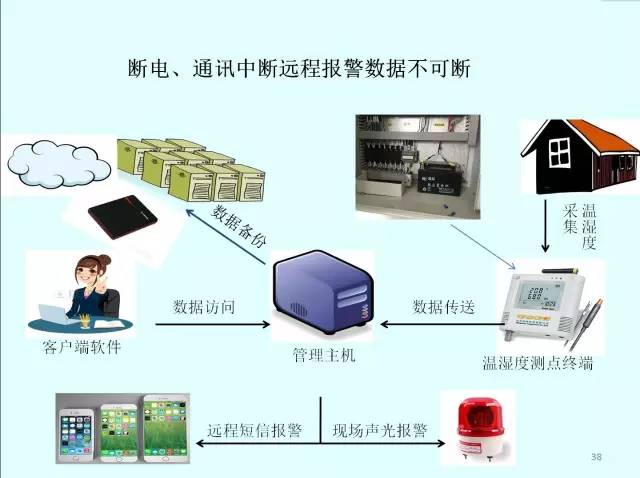
2.企業庫房配備的溫濕度自動監測系統應滿足:
(1)企業藥品倉庫儲存和冷鏈運輸設備中配備溫濕度自動監測系統。
(2)系統對藥品儲存過程的溫濕度狀況進行實時自動監測和記錄。
(3)對冷鏈藥品運輸過程的溫度的狀況進行實時自動監測和記錄。
(4)系統由測點終端、管理主機、不間斷電源以及相關軟件等組成。
(5)各測點終端對周邊環境溫濕度數據實時采集、傳送和報警。
(6)管理主機對數據有收集、處理、記錄、報警管理功能。
(7)溫濕度記錄:溫度值、濕度值、日期、時間、測點位置、庫區或運輸工具類別等。
設施與設備*04704
? 庫房應當配備自動監測、記錄庫房溫濕度的設備。
〈解讀〉
系統溫濕度測量設備的最大允許誤差應當符合以下要求:
(1)測量范圍在0℃—40℃之間,溫度的最大允許誤差為±0.5℃;
(2)測量范圍在-25℃—0℃之間,溫度的最大允許誤差為±1.0℃;
(3)相對濕度的最大允許誤差為±5%RH。
設施與設備*04704
? 庫房應當配備自動監測、記錄庫房溫濕度的設備。
〈解讀〉
(1)系統測點終端布點方案進行測試和確認。
(2)系統測點終端安裝位置不得隨意變動。
(3)系統測點終端每年至少進行一次校準。
(4)系統設備進行定期檢查、維修、保養,并建立檔案。
(5)系統滿足相關部門實施在線遠程監管的條件。
如:
? 庫房溫濕度自動監測系統不符合GSP要求
? 未對庫房溫濕度自動監測系統記錄的數據按日備份。
? 企業收貨人員未對冷鏈藥品運輸方式、在途溫度數據、運輸時間等質量狀況進行重點檢查:未對藥品的到達時間作記錄;
? 收集的運輸過程溫度記錄同一頁面中,所顯示的設備編號、運單編號均不一致等。
設施與設備04708
? 庫房應當有驗收、發貨、退貨的專用場所。
〈解讀〉
1.藥品待驗區域有明顯標識,并與其他區域有效隔離。
2.待驗區域符合待驗藥品的儲存溫度要求。
3.驗收設施設備清潔,不得污染藥品。
4.經營中藥飲片的,應有中藥飲片零貨稱取庫(區)。
如:庫房未設立驗收、發貨、退貨的專用場所
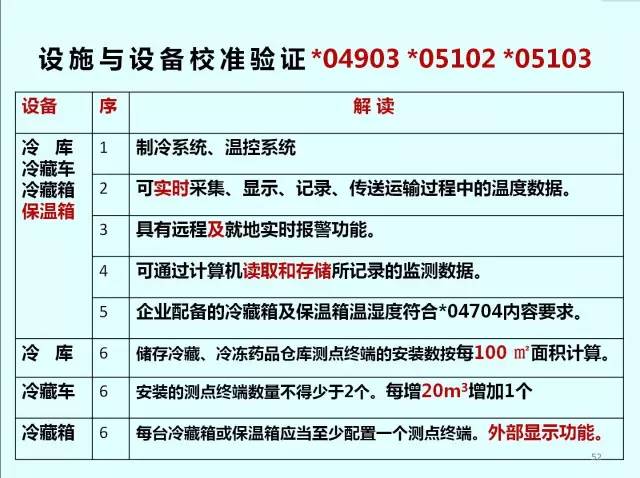
設施與設備*04901
? 經營冷藏、冷凍藥品的,應當配備與其經營規模和品種相適應的冷庫。
〈解讀〉
1.冷庫設計應當符合國家相關標準要求。
2.應當合理劃分冷庫收貨驗收、儲存、包裝材料預冷、裝箱發貨、待處理藥品存放等區域,并有明顯標示。
設施與設備*04906
? 經營冷藏、冷凍藥品的應當配備冷藏車。
〈解讀〉
1.冷藏車的配置符合國家相關標準要求。
2.冷藏車廂具有防水、密閉、耐腐蝕等性能。
3.冷藏車廂內部留有保證氣流充分循環的空間。
設施與設備*04907
? 經營冷藏、冷凍藥品的應當配備車載冷藏箱或者保溫箱等設備。
〈解讀〉
1.冷藏箱、保溫箱具有良好的保溫性能。
2.冷藏箱具有自動調控溫度的功能。
3.保溫箱配備蓄冷劑以及與藥品隔離的裝置。
校準與驗證*05101
? 運輸冷藏、冷凍藥品的冷藏車及車載冷藏箱、保溫箱應當符合藥品運輸過程中對溫度控制的要求。
〈解讀〉
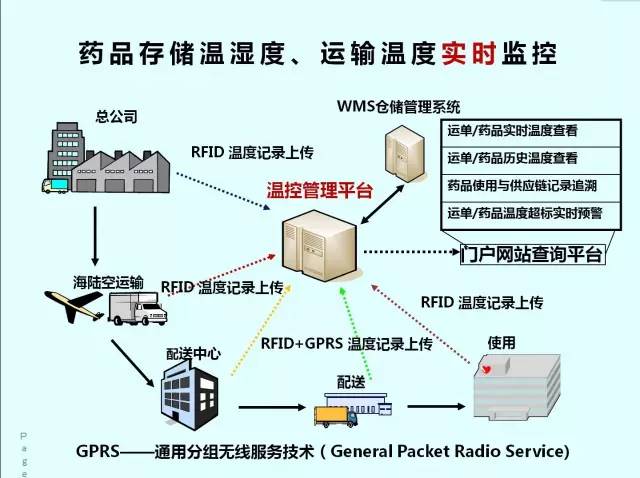
企業運輸冷藏、冷凍藥品,應當根據藥品數量、運輸距離、運輸時間、溫度要求、外部環境溫度等情況,選擇適宜的運輸工具和溫控方式,確保運輸過程溫度符合要求。(海陸空進銷、短存、短撥、轉撥)
如:
? 未按要求每年校準溫濕度監測設備
? 未按規定每年校準或檢定計量器具和溫濕度監測設備;
? 企業未對溫濕度測點終端定期進行校準或檢定;
企業未對溫濕度自動監測系統進行驗證。
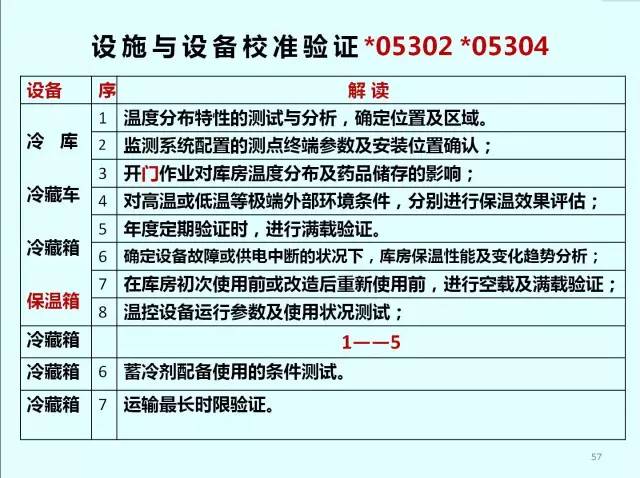
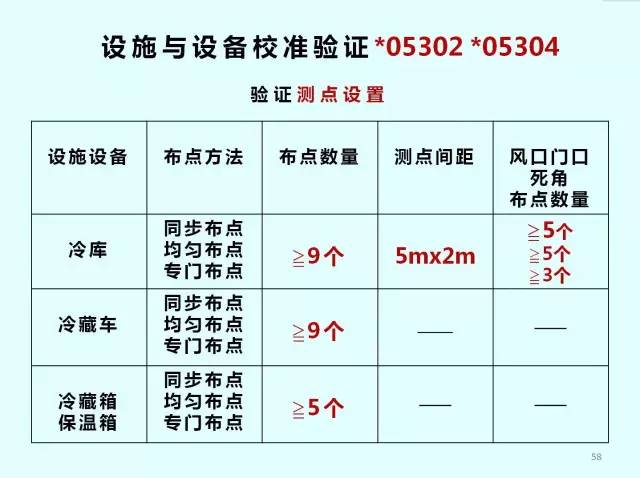
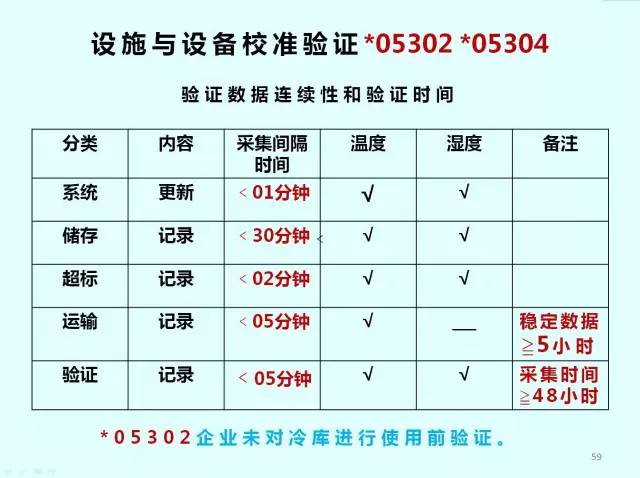
校準與驗證*05303
? 企業應當對儲運溫濕度監測系統進行使用前驗證、定期驗證及停用時間超過規定時限的驗證。
〈解讀〉
? 監測系統驗證:
1.采集、傳送、記錄數據以及報警功能的確認。
2.監測設備的測量范圍和準確度確認。
3.測點終端安裝數量及位置確認。
4.監測系統與溫度調控設施無聯動狀態的獨立安全運行性能確認。
5.系統在斷電、計算機關機狀態下的應急性能確認。
6.防止用戶修改、刪除、反向導入數據等功能確認。
7、定期驗證間隔時間不超過1年。
校準與驗證*05401
? 企業應當根據相關驗證管理制度,形成驗證控制文件,包括驗證方案、報告、評價、偏差處理和預防措施等。
〈解讀〉
1. 年度驗證計劃,即:范圍、日程、項目,實施驗證。
2. 驗證控制文件,即:驗證方案、標準、報告、評價、偏差處理和預防措施.
① 驗證方案,即:驗證的實施人員、對象、目標、測試項目、驗證設備及監測系統描述、測點布置、時間控制、數據采集要求,以及實施驗證的相關基礎條件。
② 驗證標準和驗證操作規程的制定。
③ 驗證報告,即:驗證實施人員、驗證過程中采集的數據匯總、各測試項目數據分析圖表、驗證現場實景照片、各測試項目結果分析、總體評價
④ 驗證偏差,調整和糾正處理,設施設備及監測系統符合規定的要求。
⑤ 驗證結果對可能存在的影響藥品質量安全的風險,制定預防措施。
校準與驗證05501
? 驗證應當按照預先確定和批準的方案實施。
〈解讀〉
? 企業應當根據驗證方案實施驗證。
-
使用前驗證,對設計或預定的關鍵參數、條件及性能進行確認,確定實際的關鍵參數及性能符合設計或規定的使用條件。
-
設備異常或故障時,要查找原因、評估風險,采取適當的糾正措施,并跟蹤效果。
-
定期驗證,以確認其符合要求,定期驗證間隔時間不超過1年。
-
根據相關設施設備和監測系統的設計參數以及通過驗證確認的使用條件,分別確定最大的停用時間限度;超過最大停用時限的,在重新啟用前,要評估風險并重新進行驗證。
〈解讀〉
-
驗證方案需經企業質量負責人審核并批準后,方可實施。
-
應當確保所有驗證數據的真實、完整、有效、可追溯。
-
企業可與具備相應能力的第三方機構共同實施驗證工作,企業應當確保驗證實施的全過程符合《規范》及附錄5的相關要求。
-
驗證報告由質量負責人審核和批準。
校準與驗證*05601
? 企業應當根據驗證確定的參數及條件,正確、合理使用相關設施設備。
〈解讀〉
1. 驗證確定的參數和條件,制定設施設備的操作、使用規程。
2. 驗證確定的參數及條件,正確、合理使用相關設施設備及監測系統。
3.未經驗證的設施、設備及監測系統,不得用于藥品冷藏、冷凍儲運管理。
4.驗證結果,作為企業制定或修訂質量管理體系文件相關內容的依據。

信息來源:上海醫藥商業行業協會
|