冷鏈違規成飛檢重災區!藥品流通企業主要缺陷分析與完善建議
日期:2017/10/9
“四個最嚴”“嚴而又嚴”的監管新要求,促使全國范圍內飛檢力度不斷加大。其中,冷藏、冷凍藥品的儲存與運輸管理,是藥監部門飛檢工作的重中之重,也是企業被查缺陷項目的“重災區”。
筆者以廣東省局官網公布的今年5月以來飛檢被查出的冷鏈相關違規情況統計,簡要分析藥品流通企業冷鏈管理的主要缺陷類別,并提出解決建議。
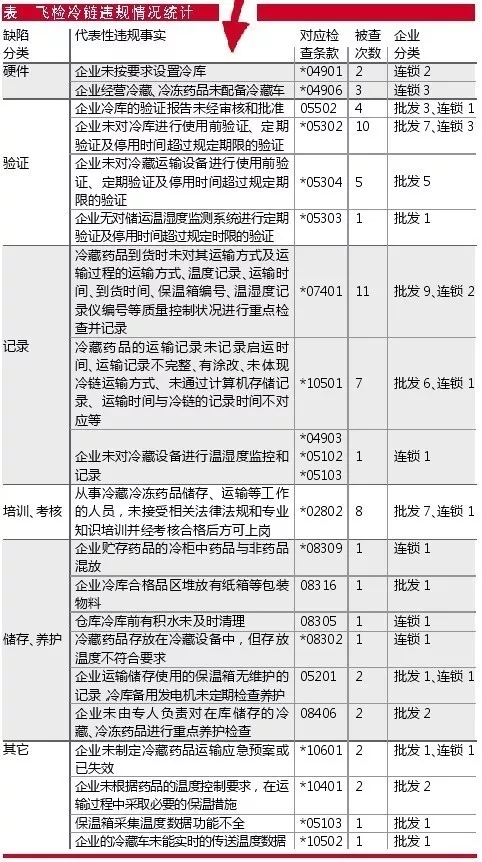
部分企業有冷鏈經營范圍,但無實際經營冷鏈品種或經營量很少,因而配備和維護冷鏈設備被認為“額外”增加了企業成本負擔,導致其存有僥幸心理想蒙混過關。
但是,GSP是藥品經營管理和質量控制的基本準則,是合規的依據,不符合要求就是違規經營。
無論有無實際經營、業務量多少,有冷藏、冷凍經營范圍的,就必須配備與經營規模和品種相適應的冷庫、冷藏車、車載冷藏箱或保溫箱,以及溫度自動監測、顯示、記錄、調控、報警等設備。
由于冷鏈管理及其相關驗證是2013年90號令后新版GSP及附錄新增的內容,是全新引入的理念,很多企業缺乏驗證相關技術、設備、經驗,驗證方案不成熟,驗證實施過程中相關數據和記錄缺少客觀性、真實性。甚至有的企業因為冷鏈方面的業務比較少,想節約成本,就干脆不做驗證,留下了一個很大的潛在風險。
出于技術和成本考慮,驗證可以考慮請第三方做。相比企業自己做驗證,第三方驗證擁有更高的權威性、真實性、可信度、實操性。如今第三方驗證已經成為一個趨勢。飛檢新形勢下,越來越多企業選擇第三方驗證,監管部門對第三方驗證的認可度也越來越高,既節省錢省時省力,又保證合規,何樂而不為?
需要特別注意的是:1.企業應當根據驗證確定的參數及條件,正確、合理使用相關設施設備及監測系統。2.未經驗證的設施、設備及監測系統,不得用于藥品冷藏、冷凍儲運管理。3.驗證的結果,應當作為企業制定或修訂質量管理體系文件相關內容的依據。
冷鏈相關記錄,為藥品儲存與運輸環節的質量保證提供了數據支持。儲存環節的缺陷相對較少,到貨驗收與配送運輸環節的問題是最多的。
到貨驗收這塊,比較常見的是供應商不配合或不太專業,常因采購量太少、路途太遠等原因沒能提供完善的冷鏈配送在途記錄。而下游客戶又催得急,來不及換別的供應商或找不到別的合格供應商,在采購部或老板的強勢干預下冒險把貨收下,相關記錄再想辦法過后補上或根本無法補上,無法保證購入藥品的在途質量。配送運輸這塊,常因冷藏車、冷藏箱、保溫箱、溫度記錄儀等設備無法滿足條件或人員操作不當,導致冷鏈運輸記錄缺失或有誤。
數據和記錄不真實也較為常見。不少企業相關人員沒有認清形勢,還停留于重業務、輕質量。對冷鏈藥品到貨“來者不拒”,不管溫度有無達標、有無冷鏈數據、有無冷鏈交接表,先收再說。而己方配送的冷鏈藥品,由于沒有根據驗證報告的指導去操作,導致在途溫度經常不達標,于是出現數據作假、冒充簽名等。
要彌補這方面的缺陷,除了要對首營企業的質量保證能力嚴格審核之外,還要在驗收環節嚴格把關,加強培訓并嚴格要求相關部門或人員,真實記錄和及時收集冷鏈信息,不符合要求的要拒收,不能受其它部門或人員的干擾,更不能弄虛作假。
培訓、考核方面的缺陷,反映相關崗位人員對冷鏈管理知識的欠缺、崗前培訓的不到位。
按照GSP的要求,從事冷藏、冷凍藥品收貨、驗收、儲存、養護、出庫、運輸配送等崗位的人員,應當接受相關法律法規、專業知識、相關制度和標準操作規程的培訓,經考核合格后方可上崗。每年至少開展一次各崗位人員的繼續教育培訓。培訓工作應當做好記錄并建立檔案。培訓檔案應包括:培訓方案、培訓實施(含授課講義提綱、簽到單)、培訓考核(試卷)情況等。
儲存和養護也是企業對冷藏、冷凍藥品容易忽略的方面。
按照GSP要求,藥品與非藥品、外用藥與其他藥品應分開存放。藥品儲存作業區內不得存放與儲存管理無關的物品。儲存藥品應當按照要求采取避光、遮光、通風、防潮、防蟲、防鼠等措施。企業應當按包裝標示的溫度要求儲存藥品。儲存、運輸設施設備的定期檢查、清潔和維護應由專人負責,并建立記錄和檔案。養護人員應對儲存條件有特殊要求的或者有效期較短的品種進行重點養護。
其它缺陷或常見問題還包括:未制定有效的應急預案,保溫措施不足,溫度監測數據讀取功能不完善,由設備供應商對冷鏈數據進行記錄和管理,備用發電機組或者雙回路電路虛設,蓄冷劑未進行驗證、直接接觸藥品等。
山雨欲來風滿樓。在藥品監管新形勢下,飛檢已經常態化。藥品流通企業要想取得長足發展,就要未雨綢繆、順勢而為,全面落實GSP的各項要求,確保冷藏、冷凍藥品流通過程持續合規,確保數據及記錄的真實、完整、可追溯。合規經營才是正道!
信息來源:上海醫藥商業行業協會
|